Uit de praktijk
IC-patiënten verliezen door immobilisatie en de inflammatoire respons in de eerste tien dagen van hun opname zo’n 25% van hun spiermassa, overeenkomend met een spiermassaverlies van 1 kg per dag. Ondanks snel behandelen van de onderliggende ziekte en optimale voeding persisteert spiermassaverlies in deze fase. Daarom is voeding tijdens de herstelfase zo belangrijk.
Auteur
PROF. DR. A.R.H. (ARTHUR) VAN ZANTEN
Internist intensivist, medisch hoofd afdeling intensive care, Ziekenhuis Gelderse Vallei, Ede en hoogleraar voeding en metabole stress aan de Wageningen Universiteit en Research
Normaal leidt het toedienen van eiwitten tot een toename van aminozuren in het bloed waardoor de spieren worden aangezet tot het aanmaken van spiereiwitten. In de vroege IC-fase is er sprake van ernstige anabole resistentie. Dit fenomeen ontstaat onder andere door immobilisatie, insulineresistentie, inflammatie en mitochondriële dysfunctie (gebrek aan ATP-productie). Er is dan een veel hogere dosis eiwitten en beweging nodig om dezelfde spier-eiwitsynthese te realiseren. Daarbij wordt nog een belangrijk deel van de voedingseiwitten gebruikt voor het maken van acute fase eiwitten betrokken bij de ontstekingsreactie.
Wat is de oplossing?
In de vroege fase kan het toedienen van extra voeding bij IC-patiënten leiden tot een slechtere uitkomst met langer orgaanfalen en een hogere kans op overlijden.1,2 Aan het eind van de eerste IC-week zou een hogere toediening van eiwit wel kunnen dienen als substraat voor eiwitsynthese van spiereiwitten en het massaverlies enigszins beperken. Het is nog onduidelijk welke dosis noodzakelijk is in deze fase. Naarmate de acute fase van het ziek zijn langer geleden is, lijkt anabole resistentie af te nemen en kan eiwittoediening in combinatie met bewegen een groter effect hebben op het herstellen van de spiermassa.
Hoe is de effectiviteit van voedingstherapie op de intensive care?
Uit grote observationele studies blijkt dat de gemiddelde toediening van energie (kcal/dag) op de intensive care te laag is en het vaak 14 dagen duurt voordat een patiënt op zijn calorisch doel is aangekomen.3 De in internationale richtlijnen geadviseerde eiwittoediening van meer dan 1,3 g/kg lichaamsgewicht wordt in vrijwel geen enkele studie gehaald. Gemiddeld wordt op de IC een eiwitinname van 0,7-0,8 g/kg lichaamsgewicht per dag gehaald. Tot nu toe is er geen overtuigend bewijs dat tijdens IC-opname veel verschil kan worden gemaakt. De kansen op herstel van de spiermassa ontstaan pas als de ontstekingsreactie en insulineresistentie verdwijnt en de ATP-productie herstelt.
Hoe gaat het na ontslag van de intensive care?
Veel patiënten krijgen na hun IC-opname het Post-Intensive-Care-Syndroom (PICS). Hierbij spelen combinaties van de Trias mentale stoornissen, zoals angst, depressie en posttraumatische stressstoornis, cognitief verval en verlies van spierkracht en -functie. Deze symptomen leiden er vaak toe dat patiënten niet naar huis kunnen worden ontslagen vanuit het ziekenhuis. De afgelopen jaren is het aantal patiënten dat naar een verpleeghuis of een revalidatiecentrum wordt ontslagen verdrievoudigd.
‘De afgelopen jaren is het aantal
patiënten dat na IC-opname
naar een verpleeghuis of een
revalidatiecentrum wordt ontslagen
verdrievoudigd’
Is de voedingstherapie na IC-ontslag voldoende om te kunnen herstellen?
Recentelijk deden wij onderzoek naar de voedingsinname na ontslag van de IC op de verpleegafdelingen van ons ziekenhuis in de prospect-I studie.4 Door analyse van alle bestellingen van het roomservicesysteem van ons ziekenhuis, waarbij voor en na het eten foto’s van de dienbladen met de bestellingen werden beoordeeld, konden wij exact de voedingsinname meten. Gemiddeld waren er tekorten van 30% in energie en 40% in eiwitinname. Het grootste risicomoment vormde het verwijderen van de voedingssonde. De dag na verwijdering halveerde de energie- en eiwitinname. Inmiddels hebben wij geïndividualiseerde afbouwschema’s voor sondevoeding gemaakt, waarbij met eiwit- en energieverrijkte voedingsmiddelen in combinatie met drinkvoeding (oral nutritional supplements) alles wordt gedaan om een terugval in inname te voorkomen.
Waarom eten patiënten minder na IC-ontslag?
Er zijn een veelheid aan factoren die bijdragen aan een verminderde inname van voedingsmiddelen door patiënten na IC-ontslag. Deze zijn samengevat in figuur 1.
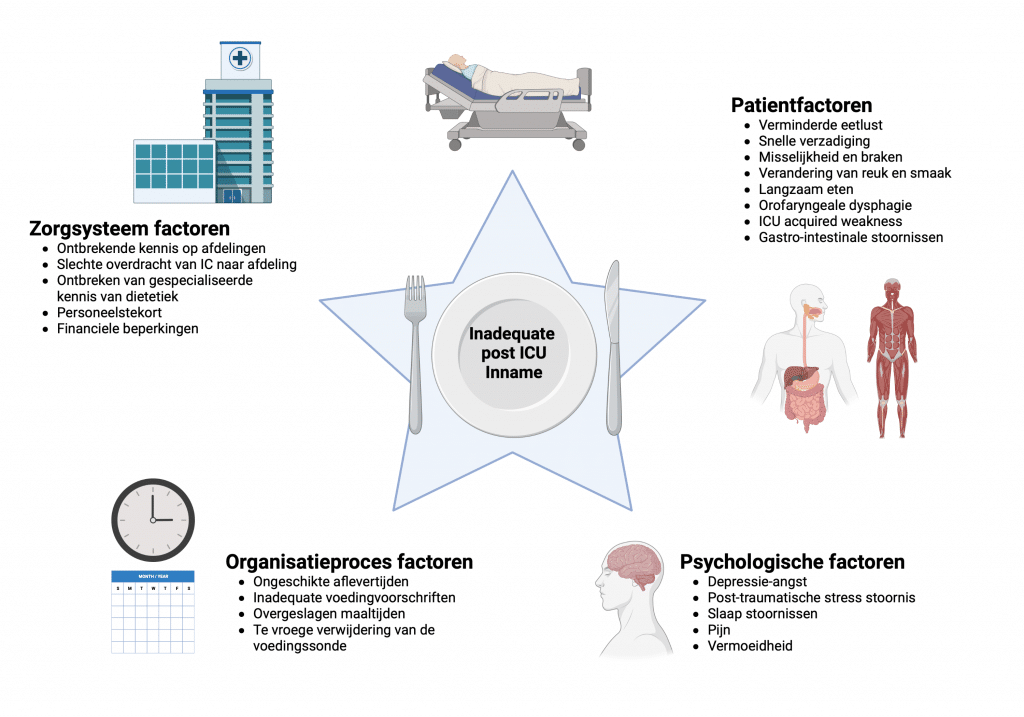
Created with biorender.com A.R.H. van Zanten, License number: WR24QAQ8RA]
Welke doelen streven we na?
Momenteel zijn er geen specifieke voedingsrichtlijnen voor post-IC-patiënten. Wel kunnen we leren van het Minnesota Starvation Project, waarbij gezonde jonge mannen op een hypocalorisch dieet afvielen tot een BMI <14. Daarna volgden ze een Refeeding schema . Het kostte een jaar om het gewicht en de spiermassa te herstellen met een dieet van meer dan 4.000 kcal/dag en drie maal de normale dagelijkse eiwitinname.5 Dit zijn voor oudere patiënten vrijwel onhaalbare doelen. Zonder medische voeding zoals drinkvoeding kunnen deze doelen nooit worden bereikt.
‘Goede monitoring en bevordering
van het behalen van voedingsdoelen
en het periodiek meten van
de voedingstoestand van patiënten
is essentieel’
Aanbevelingen over voeding tijdens de revalidatiefase
Patiënten na ontslag uit het ziekenhuis na een ernstig ziektebeloop met bijvoorbeeld langdurige immobilisatie of IC-opname hebben energie- en eiwitverrijkte voeding nodig, vaak aangevuld met drinkvoeding, om de hoge voedingsdoelen te halen. Idealiter in combinatie met voldoende spierinspanning om het spiermassaverlies te herstellen. Echter, eiwitrijke voeding is duurder dan eiwitarme voeding. Financiële beperkingen mogen gezien het grote belang geen rol spelen. Gelukkig zien we steeds meer aandacht en middelen voor optimale voedingstherapie tijdens revalidatie. Goede monitoring en bevordering van het behalen van voedingsdoelen en het periodiek meten van de voedingstoestand van patiënten is essentieel. Hiervoor is optimale samenwerking tussen zorgprofessionals in alle zorgechelons nodig, en multimodale behandelingsstrategieën die voeding incorporeren.
Referenties
- Zusman O, Theilla M, Cohen J, Kagan I, Bendavid I, Singer P. Resting energy expenditure, calorie and protein consumption in critically ill patients: a retrospective cohort
study. Crit Care 2016;20(1):367. doi:10.1186/s13054-016-1538-4. PMID: 27832823; PMCID: PMC5105237. - Koekkoek WACK, van Setten CHC, Olthof LE, Kars JCNH, van Zanten ARH. Timing of PROTein INtake and clinical outcomes of adult critically ill patients on prolonged
mechanical VENTilation: The PROTINVENT retrospective study. Clin Nutr 2019;38(2):883-90. doi:10.1016/j.clnu.2018.02.012. Epub 2018 Feb 17. PMID: 29486907. - Bendavid I, Singer P, Theilla M, Themessl-Huber M, Sulz I, Mouhieddine M, Schuh C, Mora B, Hiesmayr M. NutritionDay ICU: A 7 year worldwide prevalence study of
nutrition practice in intensive care. Clin Nutr 2017;36(4):1122-29. doi:10.1016/j.clnu.2016.07.012. Epub 2016 Aug 9. PMID: 27637833. - Slingerland-Boot R, van der Heijden I, Schouten N, Driessen L, Meijer S, Mensink M, van Zanten A. Prospective observational cohort study of reached protein and energy
targets in general wards during the post-intensive care period: The PROSPECT-I study. Clin Nutr 2022;41(10):2124-34. doi:10.1016/j.clnu.2022.07.031. Epub 2022 Aug 9.
PMID: 36067584. - Wischmeyer PE. Tailoring nutrition therapy to illness and recovery. Crit Care 2017;21(Suppl 3):316. doi:10.1186/s13054-017-1906-8. PMID: 29297385; PMCID: PMC5751603.
Uitgelichte NTR artikelen

De rol van voeding bij dwarslaesie
Voeden tijdens herstel van ernstige ziekte moet veel beter

Voeding bij kanker: wetenschap en praktijk